乔默生物技术(上海)有限公司品牌商
5 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.2999999999999998
- 0.2999999999999998
- 2.3
- 2.3
推荐产品
新冠蛋白SARS-CoV-2 Nucleocapsid Protein (Omicron B1.1.529 Variant), Tag Free, HEK293
品牌:Chamot Biotech/乔默生物
¥5400
咨询公司新闻/正文
细胞培养过程中,内毒素的问题您关注了吗?
4307 人阅读发布时间:2022-03-07 10:23
内毒素是什么?
内毒素是革兰氏阴性细菌细胞壁中的一种成分,叫做脂多糖(LPS)。细菌在积极生长时少量释放内毒素,在死亡时大量释放内毒素。LPS由菌体O特异性多糖(O antigen)、非特异性核心多糖(Core polysaccharide)和脂质A(Lipid A)三部分构成。脂质A是内毒素的主要毒性组分。
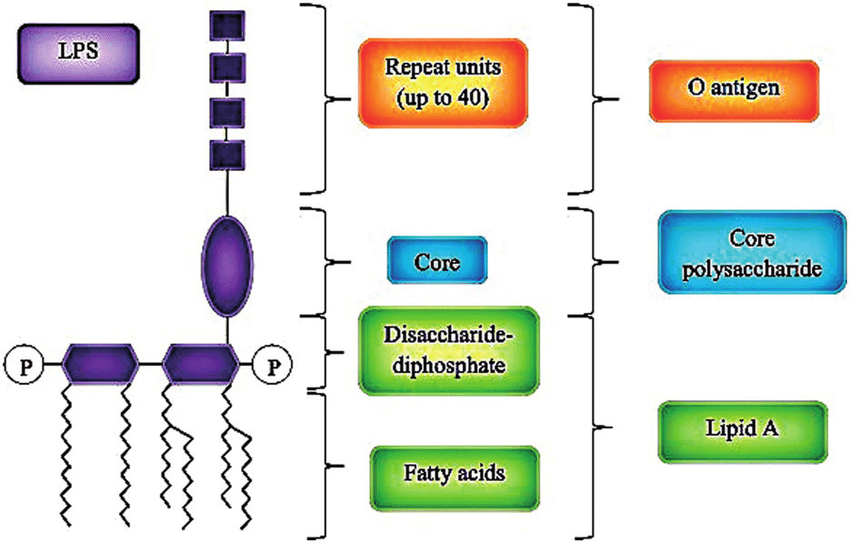
图 LPS基本结构
内毒素对机体有什么影响?
微量(0.2 -1 ng)即可引起机体发热,大剂量则具有致死毒性,并产生如下反应:
①骨髓反应;②白血球减少;③血小板减少;④诱导机体对ET 的耐受性与非特异性感染防御力;⑤局部过敏反应,即施瓦茨曼反应(Shwartzmanreaction);⑥辅药作用;⑦激活凝血系统,引起急性弥漫性血管内凝血、微循环障碍与血压降低,最终导致动物休克(Shock)、体重降低等。
内毒素对细胞有什么影响?
试剂的内毒素污染是一个潜在的重大问题,可能导致实验中的错误结论。许多细胞类型易受内毒素影响。这些细胞类型包括巨噬细胞、中性粒细胞、树突状细胞、淋巴细胞、肝细胞、内皮细胞、血小板等。内毒素在很多研究中被证实会对细胞的生长和功能造成影响,譬如:
内毒素检测方法
最开始用于检测内毒素污染的方法是20世纪40年代开发的兔热原试验,用于筛选注射人体时使用的水和溶液。该测试是基于将内毒素注射到兔子体内时引起发热(一种内毒素诱导的热原反应)的能力。虽然在减少热原发作方面非常成功,但兔试验昂贵、耗时,而且不太能定量。20世纪70年代,由Leivin和Bang发现,当遇到内毒素时,鲎的血液能够凝结成块。用鲎血液中的变形细胞提取物与待检样品混合,如果待检样品中含有内毒素,则会观察到上述情况。基于此建立了利用鲎试剂检测细菌内毒素的方法。鲎试验法已经替代了热原检查家兔法检验药品中的内毒素。
该美洲鲎试剂(Limulus Amerbocyte Lysate,LAL)凝胶血栓试验非常敏感,可检测低至0.03 内毒素单位(EU)/mL。根据所使用的参考标准,一个EU约等于0.1至0. 2ng内毒素/mL溶液。除了凝胶凝块分析,现在已经开发出更敏感的LAL动力学比浊度或显色分析,可以检测到0.001EU/mL。鲎试验法目前是国际上至今为止检测内毒素公认有效的标准检测方法,它简单、快速、灵敏、准确,因为被欧盟药典及我国药典法定为内毒素检测法,并已被世界各国所采用。
结语
虽然内毒素可能不是所有细胞培养使用者都需在意的问题,但对一些人来说显然是需要尤其需要关注的。基于细胞的产品的内毒素污染是制药行业关注的一个主要问题。内毒素也在许多细胞培养实验中被证明会影响细胞的生长和功能。在细胞培养过程中,使用常见的对低内毒素水平敏感的细胞时,尤其如此。因此,除非你确定内毒素对你的培养物没有影响,也不是你的实验中变异的潜在来源,否则你应该通过采取一些基本的预防措施来减少内毒素相关问题发生的可能性。譬如采用低内毒素的试剂组分等。
参考文献:
内毒素是革兰氏阴性细菌细胞壁中的一种成分,叫做脂多糖(LPS)。细菌在积极生长时少量释放内毒素,在死亡时大量释放内毒素。LPS由菌体O特异性多糖(O antigen)、非特异性核心多糖(Core polysaccharide)和脂质A(Lipid A)三部分构成。脂质A是内毒素的主要毒性组分。

图 LPS基本结构
内毒素对机体有什么影响?
微量(0.2 -1 ng)即可引起机体发热,大剂量则具有致死毒性,并产生如下反应:
①骨髓反应;②白血球减少;③血小板减少;④诱导机体对ET 的耐受性与非特异性感染防御力;⑤局部过敏反应,即施瓦茨曼反应(Shwartzmanreaction);⑥辅药作用;⑦激活凝血系统,引起急性弥漫性血管内凝血、微循环障碍与血压降低,最终导致动物休克(Shock)、体重降低等。
内毒素对细胞有什么影响?
试剂的内毒素污染是一个潜在的重大问题,可能导致实验中的错误结论。许多细胞类型易受内毒素影响。这些细胞类型包括巨噬细胞、中性粒细胞、树突状细胞、淋巴细胞、肝细胞、内皮细胞、血小板等。内毒素在很多研究中被证实会对细胞的生长和功能造成影响,譬如:
--微量LPS就可诱导机体巨噬细胞产生肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)和白细胞介素-6(IL-6)。
--阻止巨噬细胞游走
--诱导前列腺素(PG)生成
--降低真核细胞系的转染效率
| 细胞种类 | 浓度(ng/mL) | 内毒素的效应 |
| 马巨噬细胞 | 0.5 | 诱导产生IL-6 |
| 人体外受精胚胎细胞 | 1 | 体外受精成功率降低了 3-4倍 |
| 主动脉环 | 1 | 收缩性降低,并诱导IL-1和TNF的产生 |
| 主动脉内皮细胞 | 10 | 硫酸肝素蛋白聚糖出现剂量依赖性改变 |
| 鼠B淋巴瘤 | 10 | 免疫球蛋白轻链的产量増加30-40倍 |
| 重组CHO细胞 | 10 | 改变蛋白质生产 |
| 心肌细胞 | 10 | 诱发收缩功能障碍 |
| 人T细胞 | 100 | 在单核细胞存在下,诱导増殖和淋巴因子产生 |
| 尿道上皮细胞 | 5000 | 改变克隆效率 |
内毒素检测方法
最开始用于检测内毒素污染的方法是20世纪40年代开发的兔热原试验,用于筛选注射人体时使用的水和溶液。该测试是基于将内毒素注射到兔子体内时引起发热(一种内毒素诱导的热原反应)的能力。虽然在减少热原发作方面非常成功,但兔试验昂贵、耗时,而且不太能定量。20世纪70年代,由Leivin和Bang发现,当遇到内毒素时,鲎的血液能够凝结成块。用鲎血液中的变形细胞提取物与待检样品混合,如果待检样品中含有内毒素,则会观察到上述情况。基于此建立了利用鲎试剂检测细菌内毒素的方法。鲎试验法已经替代了热原检查家兔法检验药品中的内毒素。
该美洲鲎试剂(Limulus Amerbocyte Lysate,LAL)凝胶血栓试验非常敏感,可检测低至0.03 内毒素单位(EU)/mL。根据所使用的参考标准,一个EU约等于0.1至0. 2ng内毒素/mL溶液。除了凝胶凝块分析,现在已经开发出更敏感的LAL动力学比浊度或显色分析,可以检测到0.001EU/mL。鲎试验法目前是国际上至今为止检测内毒素公认有效的标准检测方法,它简单、快速、灵敏、准确,因为被欧盟药典及我国药典法定为内毒素检测法,并已被世界各国所采用。
结语
虽然内毒素可能不是所有细胞培养使用者都需在意的问题,但对一些人来说显然是需要尤其需要关注的。基于细胞的产品的内毒素污染是制药行业关注的一个主要问题。内毒素也在许多细胞培养实验中被证明会影响细胞的生长和功能。在细胞培养过程中,使用常见的对低内毒素水平敏感的细胞时,尤其如此。因此,除非你确定内毒素对你的培养物没有影响,也不是你的实验中变异的潜在来源,否则你应该通过采取一些基本的预防措施来减少内毒素相关问题发生的可能性。譬如采用低内毒素的试剂组分等。
关于乔默生物
乔默生物作为国内新型重组蛋白供应商,为广大研发者提供近300种重组蛋白/细胞因子,并保证所有产品极低的内毒素含量。经LAL法测定,内毒素水平小于0.1EU/μg,部分<0.01 EU/μg。最大限度消除内毒素对功能学实验的影响。欢迎垂询!参考文献:
- Weber, M., K. Möller, M. Welzcek and J.Schorr. 1995. Effects of lipopolysaccharide on transfection efficiency in eukaryotic cells.BioTechniques 19:931-939.(1995)
- Zanoni I, Granucci F. Differences in lipopolysaccharide-induced signaling between conventional dendritic cells and macrophages. Immunobiology. 215:709–712. (2010)
- Epstein, J., Lee, M.M., Kelly, C.E., and Donahue, P.K. Effect of E. Coli Endotoxin on Mammalian Cell Growth and Recombinant Protein Production. In Vitro Cell. Dev. Biol. 26:1121-1122 (1990).
- Fishel, S., Jackson, P., Webster, J. and Faratian, B. Endotoxins in Culture Medium for Human In Vitro Fertilization. Fertil. Steril. 49:108-111(1988).
- Mattern, T., Thanhauser, A., Reiling, N., Toellner, K., Duchrow, M., Kusumoto, S., Rietschel, E.T., Ernst, M., Brade, H., Flad, H.D. and Ulmer, A.J. Endotoxin and Lipid A Stimulate Proliferation of Human T Cells In the Presence of Autologous Monocytes. J. Immunol. 153:2996-3004 (1994).
- McKenna, T.M. Prolonged Exposure of Rat Aorta to Low Levels of Endotoxin In Vitro Results in Impaired Contractility. J. Clin. Invest. 86:160-168 (1990).
- Morris, D.D., Crowe, N., Moore, J.N. and Moldawer, L.L. Endotoxin-Induced Production of Interleukin 6 by Equine Peritoneal Macrophages In Vitro. Am. J. Vet. Res. 53:1298-1301 (1992).
- Sibley, C.H., Terry, A. and Raetz, C.R.H. Induction of K Light Chain Synthesis in 70Z/3 B Lymphoma Cells by Chemically Defined Lipid A Precursors. J. Biol. Chem. 263:5098-5103 (1988).
- Snyman, E. and Van der Merwe, J.V. Endotoxin-Polluted Medium in a Human In Vitro Fertilization Program. Fertil. Steril. 46:273-276 (1986).
- Tao, S. and McKenna, T.M. In vitro Endotoxin Exposure Induces Contractile Dysfunction in Adult Rat Cardiac Myocytes. Am. J. Physiol. 267:H1745-H1752 (1994).
- Wille, J.J., Park, J. and Elgavish, A. Effects of Growth Factors, Hormones, Bacterial Lipopolysaccharides, and Lipotechoic Acids on the Clonal Growth of Normal Uretal Epithelial Cells in Serum-Free Culture. J. Cell. Physiol. 150:52-58 (1992).